出典:AIGCオープンコミュニティ 画像ソース: Unbounded AIによって生成Google傘下のAI研究機関であるDeepMindは11月1日、タンパク質構造予測モデル「AlphaFold」の最新の技術進歩として、予測精度を大幅に向上させ、タンパク質からリガンド(低分子)を含む他の生体分子まで対象範囲を拡大したことを公式サイトで公開しました。AlphaFoldは、リガンド、タンパク質、核酸(DNA、RNA)、翻訳後修飾(PTM)を含む分子など、タンパク質データベース(PDB)のほぼすべての分子を、医薬品研究に不可欠な原子精密ラボのレベルまで予測できることが知られています。Alphafold タンパク質構造データベース:最新の開発: ## **タンパク質フォールディングを超えて** Googleが2020年に初めてAlphaFoldをリリースして以来、タンパク質とその相互作用の理解方法に革命をもたらし、タンパク質の3次元構造の予測に成功し、生物科学の分野で大きな技術的ブレークスルーを達成してきました。AlphaFoldは、一本鎖タンパク質の予測における根本的なブレークスルーです。 その後、AlphaFold-Multimerは複数のタンパク質鎖を含む複合体に拡大し、続いてAlphaFold 2.3が性能を向上させ、より大きな複合体のカバレッジを拡大しました。2022年、AlphaFoldの構造予測は、科学的に知られているほぼすべてのカタログ化されたタンパク質をカバーし、欧州バイオインフォマティクス研究所(EMBL-EBI)との共同研究により、AlphaFold Protein Structure Databaseで自由に利用できるようになりました。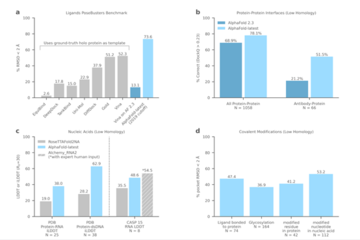 現在までに、190カ国以上で140万人のユーザーがAlphaFoldタンパク質構造データベースにアクセスしており、世界中の科学者がAlphaFoldの予測を使用して、新しいマラリアワクチンの開発の加速やがん治療薬の発見**の推進から、汚染に対処するためのプラスチック分解酵素の開発まで、さまざまな研究の進歩に役立てています。最新のAlphaFoldモデルは、タンパク質のフォールディングにとどまらず、リガンド、タンパク質、核酸、翻訳後修飾の構造予測精度も高い。 ## **医薬品開発の加速** データ解析の結果、最新のAlphaFoldモデルは、抗体結合など、創薬に関連するいくつかのタンパク質構造予測問題において、AlphaFold 2.3よりも有意に優れていることが示されました。 さらに、タンパク質やリガンド構造の正確な予測は創薬の重要なツールであり、科学者が医薬品になる可能性のある新しい分子を特定して設計するのに役立ちます。製薬業界では、リガンドとタンパク質の相互作用を決定するために「ドッキング法」を使用するのが現在の標準です。 これらのドッキング法には、厳格な参照タンパク質構造と推奨されるリガンド結合部位が必要です。最新のAlphaFoldモデルは、タンパク質構造やリガンドポケットの位置を参照することなく、報告されたドッキング法よりも優れたドッキング方法により、タンパク質-リガンド構造予測の新しい基準を設定し、これまで構造的に特徴付けられたことのないまったく新しいタンパク質の予測を可能にします。また、すべての原子の位置を協調モデル化することもでき、ドッキング法では不可能な、他の分子との相互作用におけるタンパク質や核酸の固有の柔軟性を完全に表現することができます。例えば、最新のAlphaFoldモデルによって予測された構造(色で表示)が、実験的に決定された構造(灰色で表示)と密接に一致した、最近発表された3つの治療関連のケースを次に示します。 PORCN(1)、KRAS(2)、PI5P4Kγ(3)の予測。PORCN:標的と他のタンパク質に結合する臨床段階の抗がん分子。KRAS:重要ながん標的の共有結合リガンド(分子接着剤)で形成される三元複合体。PI5P4Kγ:がんや免疫疾患など複数の疾患に作用する脂質キナーゼの選択的アロステリック阻害剤。 ## **生物学の新しい理解** 最新のAlphaFoldモデルは、タンパク質やリガンド構造、核酸や翻訳後修飾を含む構造のモデリングを可能にすることで、基礎となる生物学を調べるためのより速く、より正確なツールを提供します。例えば、CRISPRファミリーの一部であるcrRNAやDNAに結合するCasLambdaの構造が関係しています。CasLambdaは、研究者が動物、植物、微生物のDNAを改変するために使用できる「遺伝子ハサミ」として広く知られているCRISPR-Cas9システムと遺伝子編集の力を共有しています。 CasLambdaのサイズが小さいため、遺伝子編集での使用がより効率的になる可能性があります。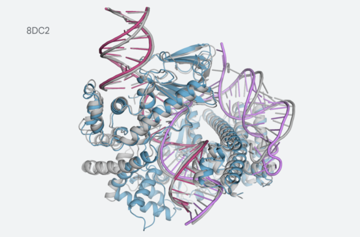 crRNAおよびDNA(CRISPRサブシステムの一部)に結合したCasLambda(Cas12l)の予測構造。このような複雑なシステムをモデル化するAlphaFoldの能力は、AIモデルが医療バイオテクノロジーコミュニティがこれらのタイプのメカニズムをよりよく理解し、治療プロセスへの応用を加速させるのに役立つことを示唆しています。GoogleのDeepMindによると、最新のAlphaFoldモデルは、ゲノミクス、バイオ再生可能材料、植物免疫、潜在的な治療標的、医薬品設計などの詳細かつ重要な予測を提供し、生物医学のブレークスルーを支援し、「デジタル生物学」の次の時代を構築することができます。
GoogleのAlphaFoldモデルが大きなブレークスルーをもたらしました! 生体分子、リガンドの予測が可能
出典:AIGCオープンコミュニティ
Google傘下のAI研究機関であるDeepMindは11月1日、タンパク質構造予測モデル「AlphaFold」の最新の技術進歩として、予測精度を大幅に向上させ、タンパク質からリガンド(低分子)を含む他の生体分子まで対象範囲を拡大したことを公式サイトで公開しました。
AlphaFoldは、リガンド、タンパク質、核酸(DNA、RNA)、翻訳後修飾(PTM)を含む分子など、タンパク質データベース(PDB)のほぼすべての分子を、医薬品研究に不可欠な原子精密ラボのレベルまで予測できることが知られています。
Alphafold タンパク質構造データベース:
最新の開発:
タンパク質フォールディングを超えて
Googleが2020年に初めてAlphaFoldをリリースして以来、タンパク質とその相互作用の理解方法に革命をもたらし、タンパク質の3次元構造の予測に成功し、生物科学の分野で大きな技術的ブレークスルーを達成してきました。
AlphaFoldは、一本鎖タンパク質の予測における根本的なブレークスルーです。 その後、AlphaFold-Multimerは複数のタンパク質鎖を含む複合体に拡大し、続いてAlphaFold 2.3が性能を向上させ、より大きな複合体のカバレッジを拡大しました。
2022年、AlphaFoldの構造予測は、科学的に知られているほぼすべてのカタログ化されたタンパク質をカバーし、欧州バイオインフォマティクス研究所(EMBL-EBI)との共同研究により、AlphaFold Protein Structure Databaseで自由に利用できるようになりました。
最新のAlphaFoldモデルは、タンパク質のフォールディングにとどまらず、リガンド、タンパク質、核酸、翻訳後修飾の構造予測精度も高い。
医薬品開発の加速
データ解析の結果、最新のAlphaFoldモデルは、抗体結合など、創薬に関連するいくつかのタンパク質構造予測問題において、AlphaFold 2.3よりも有意に優れていることが示されました。 さらに、タンパク質やリガンド構造の正確な予測は創薬の重要なツールであり、科学者が医薬品になる可能性のある新しい分子を特定して設計するのに役立ちます。
製薬業界では、リガンドとタンパク質の相互作用を決定するために「ドッキング法」を使用するのが現在の標準です。 これらのドッキング法には、厳格な参照タンパク質構造と推奨されるリガンド結合部位が必要です。
最新のAlphaFoldモデルは、タンパク質構造やリガンドポケットの位置を参照することなく、報告されたドッキング法よりも優れたドッキング方法により、タンパク質-リガンド構造予測の新しい基準を設定し、これまで構造的に特徴付けられたことのないまったく新しいタンパク質の予測を可能にします。
また、すべての原子の位置を協調モデル化することもでき、ドッキング法では不可能な、他の分子との相互作用におけるタンパク質や核酸の固有の柔軟性を完全に表現することができます。
例えば、最新のAlphaFoldモデルによって予測された構造(色で表示)が、実験的に決定された構造(灰色で表示)と密接に一致した、最近発表された3つの治療関連のケースを次に示します。
PORCN:標的と他のタンパク質に結合する臨床段階の抗がん分子。
KRAS:重要ながん標的の共有結合リガンド(分子接着剤)で形成される三元複合体。
PI5P4Kγ:がんや免疫疾患など複数の疾患に作用する脂質キナーゼの選択的アロステリック阻害剤。
生物学の新しい理解
最新のAlphaFoldモデルは、タンパク質やリガンド構造、核酸や翻訳後修飾を含む構造のモデリングを可能にすることで、基礎となる生物学を調べるためのより速く、より正確なツールを提供します。
例えば、CRISPRファミリーの一部であるcrRNAやDNAに結合するCasLambdaの構造が関係しています。
CasLambdaは、研究者が動物、植物、微生物のDNAを改変するために使用できる「遺伝子ハサミ」として広く知られているCRISPR-Cas9システムと遺伝子編集の力を共有しています。 CasLambdaのサイズが小さいため、遺伝子編集での使用がより効率的になる可能性があります。
このような複雑なシステムをモデル化するAlphaFoldの能力は、AIモデルが医療バイオテクノロジーコミュニティがこれらのタイプのメカニズムをよりよく理解し、治療プロセスへの応用を加速させるのに役立つことを示唆しています。
GoogleのDeepMindによると、最新のAlphaFoldモデルは、ゲノミクス、バイオ再生可能材料、植物免疫、潜在的な治療標的、医薬品設計などの詳細かつ重要な予測を提供し、生物医学のブレークスルーを支援し、「デジタル生物学」の次の時代を構築することができます。